IL-1家族包含11个成员(IL-1F1至IL-1F11),由不同基因编码,根据功能可分为促炎因子(如IL-1α、IL-1β、IL-18)和抗炎因子(如IL-1受体拮抗剂IL-1RA)[1-2]。
IL-1β(Interleukin-1β)作为该家族的核心促炎成员,与IL-1α共同通过IL-1受体(IL-1R)介导炎症反应[3]。IL-1β由人类染色体2q14.1上的IL1B基因编码,其初始转录产物为无活性的前体蛋白(pro-IL-1β)[4]。该前体蛋白由269个氨基酸组成,分子量约31 kDa,因缺乏典型的信号肽序列而无法直接分泌,需经蛋白酶(如caspase-1)切割后才可转化为具有活性的IL-1β(17 kDa,含153个氨基酸)[5]。成熟的IL-1β具有典型的β-三叶草结构,其与IL-1R1受体C端结构域的特异性结合是发挥促炎功能的关键分子基础[6]。
双重信号机制严格调控
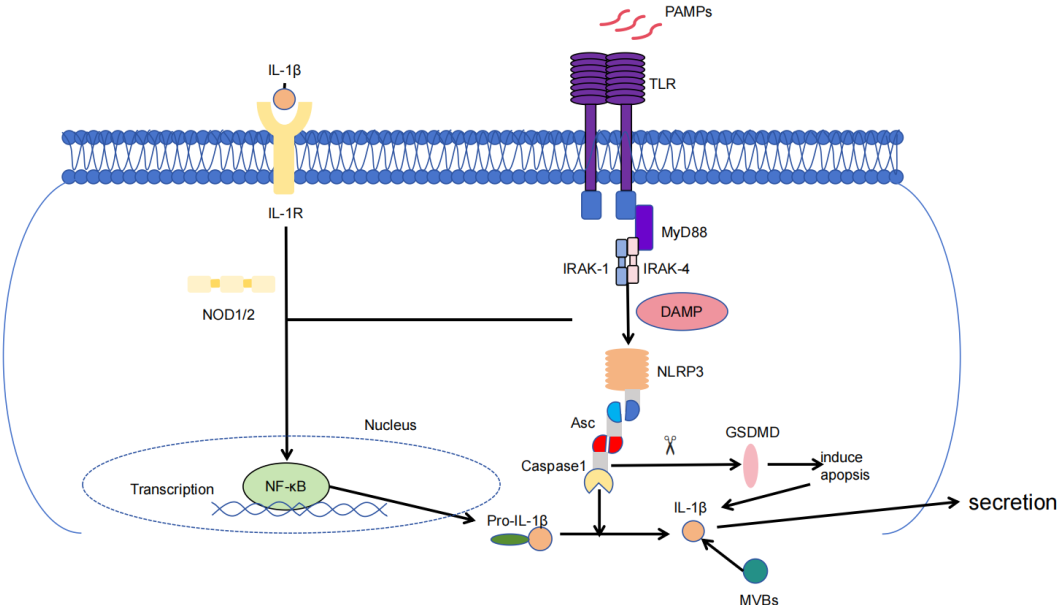
IL-1β主要由髓系免疫细胞(如单核细胞、巨噬细胞和中性粒细胞)以及组织驻留细胞(如上皮细胞和成纤维细胞)在炎症刺激下分泌。其生物合成受到双重信号机制的严格调控:第一信号通过模式识别受体(Pattern Recognition Receptors,PRRs)激活NF-κB通路,促进IL1B基因转录并合成无活性的pro-IL-1β;第二信号由危险相关分子模式(Damage Associated Molecular Patterns,DAMPs)触发NLRP3(NOD-like receptor family pyrin domain containing 3)炎症小体组装,通过caspase-1介导的蛋白水解作用将前体转化为具有生物活性的成熟IL-1β。这种级联调控机制将病原体识别与炎症反应强度相偶联,在宿主防御和病理性炎症中发挥核心作用[7]。
炎症作用与信号机制
白细胞介素-1β(IL-1β)作为炎症微环境的关键介质,IL-1β在组织损伤或感染部位呈现快速释放特征,其通过诱导内皮细胞粘附分子表达、促进炎症部位募集炎性细胞及通过基质细胞释放趋化因子等机制启动急性炎症应答。同时,该因子在慢性疾病中表现出双向作用:既可促进组织修复和病原体清除,又能介导过度炎症导致器官损伤[8]。这种功能多效性与其动态调控网络紧密关联,IL-1β通过结合IL-1受体(IL-1R1)募集衔接蛋白MyD88,激活IRAK1/TRAF6复合体并启动NF-κB通路驱动促炎基因转录;而已激活的IRAK与TRAF6,通过K63泛素化修饰激活TAK1(TGF-β活化激酶1),TAK1作为MAPK级联反应的核心枢纽,同时启动下游MAPK通路,此时AP-1调控基质金属蛋白酶(MMPs)等组织重塑因子表达[9-11]。此外,IL-1β还能自分泌诱导NLRP3炎症小体活化,形成持续放大的炎症信号环路,这种自我强化机制既是宿主防御的关键,也是炎症风暴的潜在诱因[12]。
功能或作用机制
01 启动步骤
PRR介导的pro-IL-1β转录调控
病原体相关分子模式(Pathogen-associated molecular patterns,PAMPs)(如细菌脂多糖LPS或病毒RNA)通过模式识别受体PRRs(如TLR4或NOD样受体)激活下游信号。以TLR4为例,其与LPS结合后募集衔接蛋白MyD88,触发IRAK4/IRAK1激酶级联反应,最终激活NF-κB通路。NF-κB入核后结合IL1B基因启动子区的κB位点,驱动pro-IL-1β前体的转录与合成[13]。此阶段仅产生无活性的前体蛋白(约31 kDa),且细胞不会主动分泌IL-1β。
02 激活步骤
DAMP触发的炎症小体组装与成熟
危险相关分子模式(DAMPs)作为第二信号,激活NLRP3炎症小体组装。NLRP3传感器蛋白识别DAMP后寡聚化,通过热蛋白样结构域(Pyrin domain,PYD)招募衔接凋亡相关斑点样蛋白(Apoptosis-associated speck-like protein containing a CARD,ASC),形成多聚复合体;ASC通过胱天氨酸募集结构域(Caspase recruitment domain, CARD)募集pro-caspase-1,诱导其自剪切生成活性形式的caspase-1;caspase-1通过特异性切割pro-IL-1β的Asp116位点,将其转化为具有生物活性的成熟IL-1β(17 kDa)[14]。
03 分泌机制
非经典分泌途径与炎症级联放大
由于成熟IL-1β缺乏经典信号肽,因而IL-1β信号的分泌传导需caspase-1切割Gasdermin D (GSDMD),诱导细胞焦亡促进成熟IL-1β释放至胞外或通过多泡体(MVBs)与质膜融合以外泌体形式分泌[15]。
临床应用
01 感染性疾病
IL-1β在宿主抗感染免疫中具有双重作用:适度的IL-1β释放通过诱导发热、增强中性粒细胞募集及激活巨噬细胞杀菌功能,辅助清除病原体;然而,过度分泌(如脓毒症或COVID-19重症)可引发细胞因子风暴,导致多器官衰竭。临床采用IL-1受体拮抗剂或NLRP3抑制剂阻断IL-1β信号,以降低死亡率[15]。
02 自身免疫与炎症性疾病
IL-1β是类风湿关节炎(RA)、痛风性关节炎及家族性地中海热(FMF)的核心驱动因子。其通过激活滑膜成纤维细胞分泌MMPs、诱导破骨细胞分化导致关节破坏。可通过使用IL-1β抗体直接中和IL-1β或使用IL-1受体拮抗剂竞争性阻断受体信号,治疗缓解自身免疫与炎症性疾病[16]。
03 肿瘤免疫调控
IL-1β在肿瘤微环境中表现出促癌与抑癌的复杂特性;可通过激活NF-κB诱导血管生成(VEGF)、促进髓源性抑制细胞(MDSCs)扩增,抑制抗肿瘤免疫[17];同时IL-1β可通过激活淋巴T细胞并增强靶向抗癌药的疗效[18]。
04 心血管疾病
IL-1β参与动脉粥样硬化病理进程:促进内皮细胞表达黏附分子,加速单核细胞浸润;并刺激平滑肌细胞增殖及泡沫细胞形成。研究表明,IL-1β单抗可降低由炎症引发的动脉粥样硬化风险[19]。
05 神经退行性疾病
IL-1β在阿尔茨海默病(AD)及帕金森病(PD)中驱动神经炎症:激活小胶质细胞释放活性氧(ROS),加剧β-淀粉样蛋白(Aβ)沉积;此外,还可促进α-突触核蛋白异常聚集。研究显示,IL-1R拮抗剂可减轻由神经炎症所导致的认知功能障碍[20-21]。
06 移植排斥反应
器官移植后,受体免疫系统对供体同种异体抗原的识别是诱发排斥反应的核心机制。IL-1β通过激活移植物内树突状细胞(DCs)的抗原呈递功能,并驱动CD4+ T细胞向促炎性Th17亚群分化,增强炎症性细胞因子(如IL-17、IL-21)释放,从而加剧急性排斥反应和组织损伤[22]。IL-1β抗体或IL-1受体抑制剂可协同抑制Th17通路并显著延长移植物存活时间,此外,具有免疫调节功能的细胞因子(如IL-35或TGF-β)可通过拮抗IL-1β信号成为潜在辅助治疗策略[23-24]。
相关产品
|
货号 |
中文名称 |
英文名称 |
|
SEKH-0002 |
人白细胞介素1β 检测试剂盒 |
Human IL-1β ELISA Kit |
|
SEKH-0002(HS) |
人白细胞介素1β (高灵敏)检测试剂盒 |
Human IL-1β (High Sensitivity) ELISA Kit |
|
SEKM-0002 |
小鼠白细胞介素1β 检测试剂盒 |
Mouse IL-1β ELISA Kit |
|
SEKM-0002(HS) |
小鼠白细胞介素1β (高灵敏)检测试剂盒 |
Mouse IL-1β (High Sensiivity) ELISA Kit |
|
SEKM-0002(OS) |
小鼠白细胞介素1β (一步法)检测试剂盒 |
Mouse IL-1β (One-Step) ELISA Kit |
|
SEKR-0002 |
大鼠白细胞介素1β 检测试剂盒 |
Rat IL-1β ELISA Kit |
|
SEKP-0001 |
猪白细胞介素1β 检测试剂盒 |
Porcine IL-1β ELISA Kit |
|
SEKRT-0019 |
兔白细胞介素1β 检测试剂盒 |
Rabbit IL-1β ELISA Kit |
|
SEKC-0035 |
犬白细胞介素1β 检测试剂盒 |
Canine IL-1β ELISA Kit |
|
SEKCN-0153 |
鸡白细胞介素1β 检测试剂盒 |
Chicken IL-1β ELISA Kit |
|
SEKB-0363 |
牛白细胞介素1β 检测试剂盒 |
Bovine IL-1β ELISA Kit |
|
SEKMY-0002 |
猴白细胞介素1β 检测试剂盒 |
Monkey IL-1β ELISA Kit |
|
SEKS-0275 |
羊白细胞介素1β 检测试剂盒 |
Sheep IL-1β ELISA Kit |
|
SEKG-0002 |
豚鼠白细胞介素1β 检测试剂盒 |
Guinea Pig IL-1β ELISA Kit |
|
SEKF-0025 |
猫白细胞介素1β 检测试剂盒 |
Feline IL-1β ELISA Kit |
参考文献
[1]Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805-820.
[2]Dinarello C, Arend W, Sims J, et al. IL-1 family nomenclature[J]. Nature Immunology, 2010, 11: 973.
[3]Dinarello C A. Biologic basis for interleukin-1 in disease[J]. Blood, 1996, 87(6): 2095-2147.
[4]López-Anglada E, Collazos J, Montes A H, et al. IL-1β gene (+3954 C/T, exon 5, rs1143634) and NOS2 (exon 22) polymorphisms associate with early aseptic loosening of arthroplasties[J]. Scientific Reports, 2022, 12: 18382.
[5]Thornberry N A, Bull H G, Calaycay J R, et al. A novel heterodimeric cysteine protease is required for interleukin-1 beta processing in monocytes[J]. Nature, 1992, 356(6372): 768-774.
[6]Javed A, Khan E K, Brint L A J, et al. Crystal structure of the Toll/interleukin-1 receptor domain of human IL-1RAPL[J]. Journal of Biological Chemistry, 2004, 279.
[7]Lopez-Castejon G, Brough D. Understanding the mechanism of IL-1β secretion[J]. Cytokine & Growth Factor Reviews, 2011, 22.
[8]Garlanda C, Dinarello C A, Mantovani A. The interleukin-1 family: back to the future[J]. Immunity, 2013, 39.
[9]Wesche H, Henzel W J, Shillinglaw W, et al. MyD88: an adapter that recruits IRAK to the IL-1 receptor complex[J]. Immunity, 1998, 7.
[10]Cao Z, Xiong J, Takeuchi M, et al. TRAF6 is a signal transducer for interleukin-1[J]. Nature, 1996, 383.
[11]Ninomiya-Tsuji J, Kishimoto K, Hiyama A, et al. The kinase TAK1 can activate the NIK-IκB as well as the MAP kinase cascade in the IL-1 signalling pathway[J]. Nature, 1999, 398.
[12]Weber A, Wasiliew P, Kracht M. Interleukin-1beta (IL-1beta) processing pathway[J]. Science Signaling, 2010, 3.
[13]Hassamal S. Chronic stress, neuroinflammation, and depression: an overview of pathophysiological mechanisms and emerging anti-inflammatories[J]. Frontiers in Psychiatry, 2023, 14.
[14]Zhan X, Li Q, Xu G, et al. The mechanism of NLRP3 inflammasome activation and its pharmacological inhibitors[J]. Frontiers in Immunology, 2023, 13.
[15]Xia S, Zhang Z, Giri V, et al. Gasdermin D pore structure reveals preferential release of mature interleukin-1[J]. Nature, 2021, 593.
[16]Cavalli G, Dinarello C A. Treating rheumatological diseases and co-morbidities with interleukin-1 blocking therapies[J]. Rheumatology (Oxford), 2015, 54.
[17]Caronni N, La Terza F, Vittoria F M, et al. IL-1β(+) macrophages fuel pathogenic inflammation in pancreatic cancer[J]. Nature, 2023, 623.
[18]Bent R, Moll L, Grabbe S, et al. Interleukin-1 Beta-A Friend or Foe in Malignancies?[J]. International Journal of Molecular Sciences, 2018, 19.
[19]Tall A R, Bornfeldt K E. Inflammasomes and Atherosclerosis: a Mixed Picture[J]. Circulation Research, 2023, 132.
[20]Dhapola R, Hota S S, Sarma P, et al. Recent advances in molecular pathways and therapeutic implications targeting neuroinflammation for Alzheimer's disease[J]. Inflammopharmacology, 2021, 29: 1669-1681.
[21]Saghazadeh A, Ferrari C C, Rezaei N. Deciphering variability in the role of interleukin-1β in Parkinson's disease[J]. Reviews in the Neurosciences, 2016, 27: 635-650.
[22]Jones I K A, Orloff S, Burg J M, et al. Blocking the IL-1 receptor reduces cardiac transplant ischemia and reperfusion injury and mitigates CMV-accelerated chronic rejection[J]. American Journal of Transplantation, 2021, 21.
[23]Wang W, Zhao N, Li B, et al. Inhibition of cardiac allograft rejection in mice using interleukin-35-modified mesenchymal stem cells[J]. Scandinavian Journal of Immunology, 2019, 89: e12750.
[24]Regateiro F S, Howie D, Cobbold S P, et al. TGF-β in transplantation tolerance[J]. Current Opinion in Immunology, 2011, 23: 660-669.