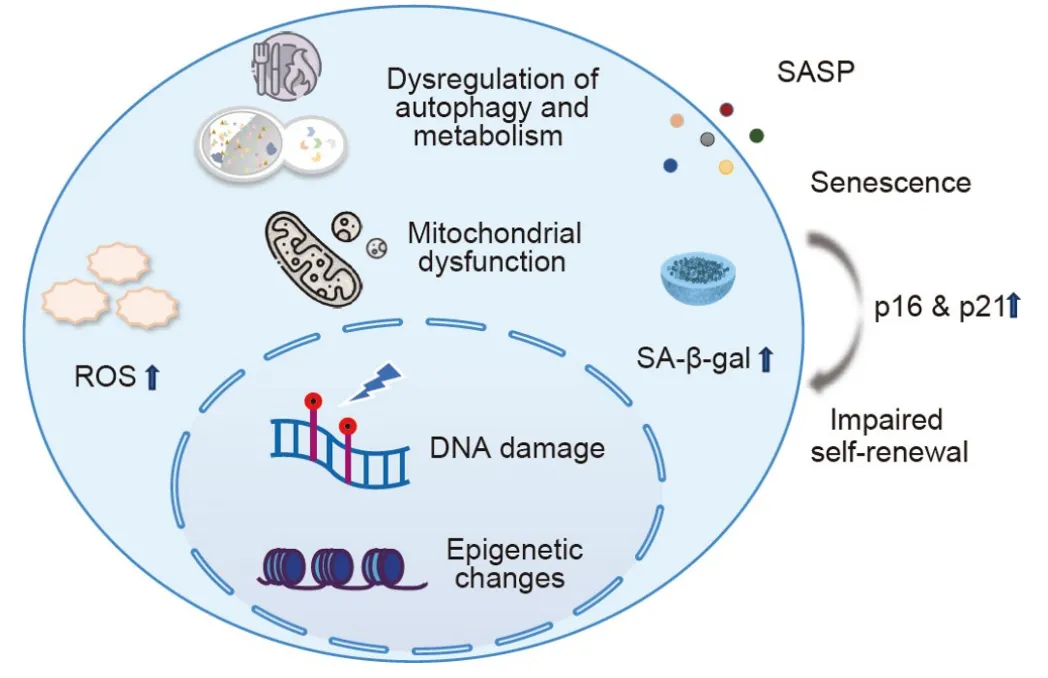
细胞发生衰老的表征变化
细胞,又称“万能细胞”,是一种未充分分化、尚不成熟的细胞,在适当条件下,具有再生各种组织、器官的潜能,因此被寄予厚望,干细胞研究也多次进入国自然研究热点排行榜前10。间充质干细胞(MSC)具有多向分化的潜能,体外在一定条件下可以诱导分化为脂肪细胞、成骨细胞、成软骨细胞,2006年国际细胞治疗协会(ISCT)确定此三项检测指标是MSC鉴定的必检项目,MSC的三系诱导在生物医药领域一直深受各位科研人员的青睐和应用。
如何构建细胞衰老模型?
可引起细胞衰老的因素有很多,我们主要介绍一下目前常见的两种细胞衰老模型构建方式,一种为D-半乳糖(D-gal)诱导的细胞衰老模型,另一种为双氧水诱导的细胞衰老模型。D-半乳糖诱导的细胞衰老模型为通过加入一定浓度的D-半乳糖引起自由基损伤,从而导致线粒体功能失调,最后造成细胞衰老;双氧水诱导的细胞衰老模型为过氧化氢作为氧化剂可造成细胞的氧化应激使其代谢失调,最终导致细胞衰老。
半乳糖诱导的细胞衰老模型建立
1. 细胞培养
选择合适的细胞系,如人胚肺成纤维细胞(HELF)、小鼠成纤维细胞(L929)等。将细胞接种于培养瓶或培养皿中,使用适宜的培养基,如含 10% 胎牛血清的 DMEM 培养基,在 37℃、5% CO?的培养箱中培养,待细胞生长至对数生长期。
2. D -半乳糖溶液配制
称取适量的 D-半乳糖,用无菌 PBS 或培养基溶解,配制成所需浓度的溶液。一般常用的浓度范围在10-100mmol/L 之间,具体浓度可根据不同细胞类型和实验目的进行优化。例如,对于HELF细胞,可尝试50mmol/L的D-半乳糖溶液。溶液需经0.22μm滤膜过滤除菌,分装后于-20℃保存备用。
3. 诱导处理
当细胞生长至合适密度(如80% - 90%汇合度)时,弃去原培养基,用PBS冲洗细胞2 - 3次。然后加入含D -半乳糖的培养基,使 D-半乳糖终浓度达到设定值。将细胞继续置于培养箱中培养,诱导时间通常为7- 14天。在诱导过程中,需定期观察细胞形态变化,并更换含D-半乳糖的培养基,一般每2 - 3天更换一次。
4. 模型鉴定
细胞形态观察:衰老细胞通常会出现体积增大、扁平,细胞质内颗粒增多等形态变化。可通过光学显微镜观察并记录细胞形态。 染色检测:衰老相关β -半乳糖苷酶(SA - β - Gal)染色:这是鉴定细胞衰老的经典方法。衰老细胞内的 SA - β - Gal 活性升高,在 pH 6.0 的条件下可将X - Gal底物水解成蓝色产物。通过染色后在显微镜下观察,计算蓝色染色细胞的比例,若比例明显高于对照组,则表明细胞衰老模型建立成功。
(仅供参考)
双氧水诱导的细胞衰老模型建立
1. 细胞培养
选择合适的细胞系,如人脐静脉内皮细胞(HUVECs)、人神经母细胞瘤细胞(SH - SY5Y)等。将细胞接种于培养瓶或培养皿中,使用对应的适宜培养基,如含10% 胎牛血清的 DMEM 培养基,在37℃、5% CO?的培养箱中培养,待细胞生长至对数生长期。
2. 过氧化氢溶液配制
一般来说,H?O?溶液的工作浓度在 50 - 200μmol/L 之间,具体浓度需根据不同细胞类型和实验目的进行优化。例如,对于HUVECs细胞,可先尝试 100μmol/L 的 H?O?溶液。由于H?O?不稳定,易分解,所以需要用新鲜的PBS或培养基现配现用。
3. 诱导处理
当细胞生长至合适密度(如70% - 80%汇合度)时,弃去原培养基,用PBS冲洗细胞2 - 3次。然后加入含 H?O?的培养基,使 H?O?终浓度达到设定值。将细胞继续置于培养箱中培养,诱导时间通常为24 - 72小时。在诱导过程中,需密切观察细胞状态,避免细胞因 H?O?浓度过高或处理时间过长而死亡。
4. 模型鉴定
细胞形态观察:衰老细胞会出现体积增大、形态不规则、细胞膜皱缩等变化。可通过光学显微镜观察并记录细胞形态。 染色检测:同 D - 半乳糖诱导细胞衰老模型鉴定方法,衰老细胞内的 SA - β - Gal 活性升高,染色后在显微镜下观察,计算蓝色染色细胞的比例,若比例明显高于对照组,则表明细胞衰老模型建立成功。
(仅供参考)
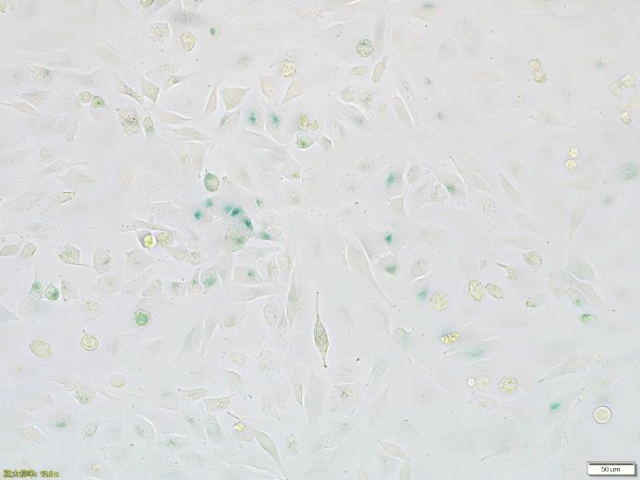
染色结果: β-半乳糖苷酶阳性部位着蓝色至蓝绿色 (hela cell)
